कार्बन एवं उसके यौगिक - पुनरावृति नोट्स
CBSE कक्षा 10 विज्ञान
पाठ-4 कार्बन एवं उसके यौगिक
पुनरावृति नोट्स
पाठ-4 कार्बन एवं उसके यौगिक
पुनरावृति नोट्स
- कार्बन एक सर्वतोमुखी तत्व है।
- कार्बन भूपर्पटी में खनिज के रूप में 2.2% उपस्थिति है। वायुमंडल में यह कार्बन डाइऑक्साइड के रूप में 0.03% उपस्थित है।
- सभी सजीव संरचनाएं कार्बन पर आधारित है।
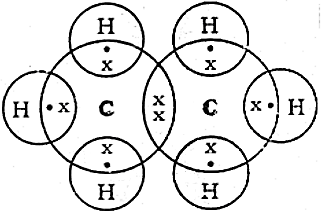
- कार्बन में सहसंयोजी आबंध:
- कार्बन की परमाणु संख्या 6 हैं तथा इलैक्ट्रॉनिक विन्यास 2.4। उत्कृष्ट गैस विन्यास को प्राप्त करने के लिये कार्बन का परमाणु।
- 4 इलेक्ट्रॉन प्राप्त कर सकता है, परंतु नाभिक के लिये 4 अतिरिक्त इलेक्ट्रॉन धारण करना कठिन है।
- 4 इलेक्ट्रॉन खो सकता है, परंतु इसके लिये अत्याधिक ऊर्जा की आवश्यकता होगी।
- इस प्रकार कार्बन के परमाणु के लिये 4 इलेक्ट्रॉन प्राप्त करना या खो देना अत्यंत कठिन होता है।
- कार्बन परमाणु उत्कृष्ट गैस विन्यास अन्य परमाणुओं के साथ संयोजकता इलेक्ट्रॉन की साझेदारी करके प्राप्त करता है।
- H, O, N एवं Cl जैसे तत्व के परमाणु साझेदारी करने में सक्षम हैं।
H2O2, N2 अणुओं के निर्माण के चित्र :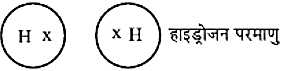

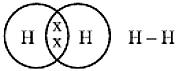
हाइड्रोजन परमाणुओं के मध्य एकल-आबंध
ऑक्सीजन परमाणु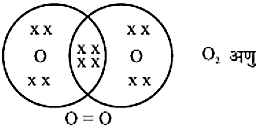
नाइट्रोजन परमाणु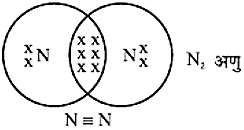
- नाइट्रोजन परमाणुओं के मध्य त्रि-आबंध
- साझा इलेक्ट्रॉन के जोड़ों की संख्या एक, दो या तीन हो सकती है। H2O तथा CH4 के अणुओं की संरचना बनाने का प्रयास करो।
- परमाणुओं के बीच इलेक्ट्रॉन के एक युग्म की साझेदारी के द्वारा बनने वाले आबंध सहसंयोजी आबंध कहलाते हैं।
- सहसंयोजी यौगिकों के क्वथनांक एवं गलनांक कम होते हैं। इसका कारण अंतरा अणुक बल का कम होना है। सामान्यतः ये अणु विद्युत के कुचालक होते हैं क्योंकि आवेशित कण नहीं बनते।
- सहसंयोजी आबंध की प्रकृति के कारण कार्बन में बड़ी संख्या में यौगिक बनाने की क्षमता हैं।
इसके दो कारक हैं-- श्रंखलन: कार्बन के परमाणु अपने मध्य आबंध बनाते हैं। इसकी प्रकार सिलिकॉन हाइड्रोजन के साथ यौगिक बनाना है।
- चतुः संयोजकता: कार्बन परमाणु की संयोजकता 4 हैं जिसके कारण यह परमाणु O, H, N, S, Cl तथा अन्य तत्वों के परमाणुओं के साथ सहसंयोजी आबंध बनाने में सक्षम है।
- कार्बन परमाणु के छोटे आकार के कारण इलेक्ट्रॉन फलस्वरूप, ये यौगिक अतिराय रूप से स्थायी होते हैं।
- संतृप्त एवं असंतृप्त कार्बनिक यौगिक:
हाइड्रोकार्बन संतृप्तः कार्बन परमाणुओं के मध्य एकल-आबंध। - एल्केन कहलाते हैं।
- कम क्रियाशील।
असंतृप्तः कार्बन परमाणुओं के मध्य द्वि या त्रि-आबंध। - एल्केन एवं एल्काईन
- अधिक क्रियाशील।
- एल्केन : CaH2n+2
- एल्कीन :CnH2n
- एल्काईन : CnH2n-2
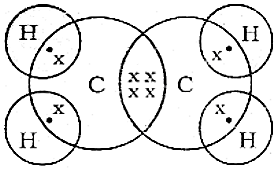
- एथेन (संतृप्त हाइड्रोकार्बन) की इलेक्ट्रॉन बिंदु संरचना
एथेन (असंतृप्त हाइड्रोकार्बन) की इलेक्ट्रॉन बिंदु संरचना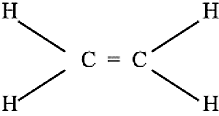
- कार्बन एवं हाइड्रोजन के संतृप्त यौगिकों के सूत्र एवं संरचनाएं
C परमाणु की संख्या नाम सूत्र संरचना 1 Methane CH4 2 Ethane C2H6 3 Propane C3H8 4 Butane C4H10 5 Pentane C5H12 - संरचना के आधार पर हाइड्रोकार्बन हो सकते हैं।
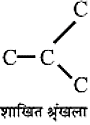
C - C - C - C सीधी श्रृंखला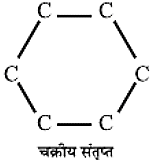
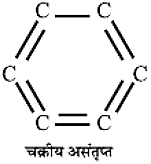
- संरचनात्मक समाचयक : वे यौगिक जिनके आणविक सूत्र तो समान होते हैं परंतु संरचना भिन्न होती हैं। उदाहरण के लिए ब्यूटेन के समावयव:
सीधी श्रृंखला वाला समावय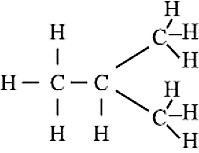
शाखित श्रृंखलीय समावयव - विषम परमाणु एवं प्रकार्यात्मक समूह : हाइड्रोकार्बन श्रृंखला में हाइड्रोजन के एक या एक से अधिक परमाणु को प्रतिस्थापित करने वाले तत्वों को विषम परमाणु कहते हैं।
- विषम परमाणु तथा वे समूह जिनका यह भाग होते हैं, यौगिक को विशिष्ट रासायनिक गुण प्रदान करते हैं, फलस्वरूप में प्रकार्यात्मक समूह कहलाते हैं।
विषम परमाणु प्रकार्यात्मक समूह प्रकार्यात्मक समूह का सूत्र Cl / Br लैलो - (क्लोरो/ब्रोमो) [-Cl2, -Br]
(हाइड्रोजन परमाणु के प्रतिस्थायी)- एल्कोहॉल [-OH] - ऐल्डिहाइड 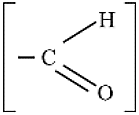
- कीटोन - कार्बोक्सिलिक - समजातीय श्रेणी : यौगिकों की वह श्रृंखला जिसमें कार्बन श्रृंखला में स्थित हाइड्रोजन एक ही प्रकार के प्रकार्यात्मक समूह द्वारा प्रतिस्थापित होता है।
उदाहरणार्थ- एल्कोहॉल :CH3 OH, C2H5 OH, C3H2 OH, C4H9 OH - समजातीय श्रेणी में उत्तरोत्तर सदस्यों में- -CH2 का अंतर तथा 14 द्रव्यमान इकाईयों का अंतर होता है।
- इन सदस्यों को प्रकार्यात्मक समूह रासायनिक विशिष्टताएं प्रदान करता हैं फलस्वरूप ये सदस्य समस्त रासायनिक गुणधर्म तथा भिन्न भौतिक गुणधर्म दर्शाते हैं।
- सदस्यों के अणु द्रव्यमान में अंतर होने के कारण इनके भौतिक गुणधर्मों में अंतर आता है।
- अणु द्रव्यमान के बढ़ने के साथ सदस्यों का गलनांक एवं क्वथनांक बढ़ता है।
- कार्बन यौगिकों की नाम पद्धति:
- यौगिक में कार्बन परमाणुओं की संख्या ज्ञात करो।
- प्रकार्यातमक समूह को पूर्वलग्न या अनुलग्न के साथ दर्शाओ।
प्रकार्यात्मक समूह अनुलग्न पूर्वलग्न ऐल्किन/द्वि-आबंध - ene ऐल्काइन/त्रि-आबंध - Yne ऐल्कोहॉल - ol ऐल्डीहाइड - al कीटोन - one कार्बोक्सिलिक अम्ल - oic acid क्लोरीन क्लोरो
- यदि एक अनुलग्न लगाया जाना हैं तब अंत का ‘e' हटाया जाता है। जैसे मेथेनॉल (Methanol) Methane-e = Methari + ol)
- कार्बनिक यौगिकों के रासायनिक गुणधर्म :
- 1. दहन
सामान्यतः ये यौगिक वायु (ऑक्सीजन) में दहित होकर कार्बन डाइऑक्साइड, जल उत्पन्न करते हैं। तथा प्रचुर मात्रा में ऊष्मा एवं प्रकाश को मुक्त करते हैं।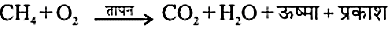
- संतृप्त हाइड्रोकार्बन वायु की प्रचुर मात्रा में जलने पर नीली ज्वाला तथा वायु की सीमित आपूर्ति में कज्जली ज्वाला उत्पन्न करते हैं।
- असंतृप्त हाइड्रोजकार्बन दहन करने पर कज्जली ज्वाला उत्पन्न करते हैं।
- कोयले तथा पेट्रोलियम के दहन द्वारा सल्फर तथा नाइट्रोजन के ऑक्साइड निर्मित होते हैं जो अम्लीय वर्षा के लिए उत्तरदायी है।
- 2. ऑक्सीकरणः
ऑक्सीकारक के रूप में अम्लीय पोटाशियम डाइक्रोमेट तथा क्षारीय पोटाशियम परमैंगनेट का उपयोग कर, एल्कोहॉल के ऑक्सीकरण के फलस्वरूप कार्बोक्सिलिक अम्ल उत्पन्न होते हैं।
CH3 - CH2 - OH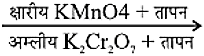 CH3COOH
CH3COOH - 3. संकलन अभिक्रियाः
निकैल या पैलेडियम की उपस्थिति में हाइड्रोजन असंतृप्त हाइड्रोकार्बन के साथ जुड़कर संतृप्त हाइड्रोकार्बन निर्मित करते हैं।
इस प्रक्रम द्वारा वनस्पति तेल को वनस्पति घी में परिवर्तित किया जाता हैं।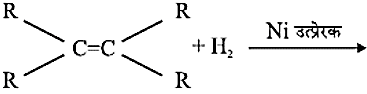
संतृप्त वसीय अम्ल स्वास्थ्य के लिये हानिकारक हैं। भोजन पकाने के लिये असंतृप्त वसीय अम्ल प्रयुक्त तेलों का उपयोग करना चाहिए। - 4. प्रतिस्थापन अभिक्रियाः
संतृप्त हाइड्रोकार्बन में, कार्बन के साथ जुड़े हाइड्रोजन को, सौर प्रकार की उपस्थिति में अन्य परमाणु या अणु से प्रतिस्थापित किया जा सकता है।
- महत्वपूर्ण कार्बन यौगिक : ऐथेनॉल एवं एथेनोइक अम्ल
- ऐथेनॉल
- गलनांक 156k
- जल में घुलनशील
- क्वथनांक 351 k
- जनाने वाला स्वाद
- ऐथेनॉल के सेवन से गंभीर स्वास्थ्य संबंधी समस्याएं हो सकती हैं तथा शुद्ध ऐथेनॉल की थोड़ी-सी मात्रा प्राणघातक सिद्ध हो सकती है।
ऐथेनॉल के रासायनिक गुणधर्म C2H5OH की सोडियम के साथ अभिक्रिया में सोडियम इथॉक्साइड तथा हाइड्रोजन उत्पन्न होती हैं। सांद्र H2SO4 के साथ 443k के तापमान पर ऐथेनॉल को निर्जलीकरण द्वारा एथीन उत्पन्न होती है। 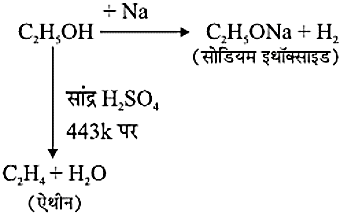
- ऐथेनॉल के उपयोग
- साबुन निर्माण में
- प्रयोगशाला अभिकारक के रूप में
- एल्कोहॉलिक पेयों में
- दवाओं तथा टॉनिक में
- ऐथेनोइक अम्ल (CH3COOH) / ऐसिटिक अम्ल:
ऐथेनोइक अम्ल- गलनांक 290 k
- जल में घुलनशील
- क्वथनांक 391 k
- स्वाद में खट्टा
- ऐसिटिक अम्ल का 5-8% का जलीय विलयन सिरका कहलाता है।
- परिशुद्ध ऐसिटिक अम्ल को ग्लैशियल ऐसिटिक अम्ल कहते हैं।
ऐथेनाइक अम्ल अभिक्रिया करता है उत्पाद सोडियम Na सोडियम एथेनोऐट एवं हाइड्रोजन गैस सोडियम कार्बोनेट Na2CO3 सोडियम एथेनोऐट एवं कार्बन डाइऑक्साइड तथा जल सोडियम बाइकार्बोनेट NaHCO3 सोडियम एथेनोऐट, कार्बन डाइऑक्साइड एवं जल एथेनॉल (सांद्र H2SO4 की उपस्थित में CH3CH2 - OH ऐस्टर तथा जल 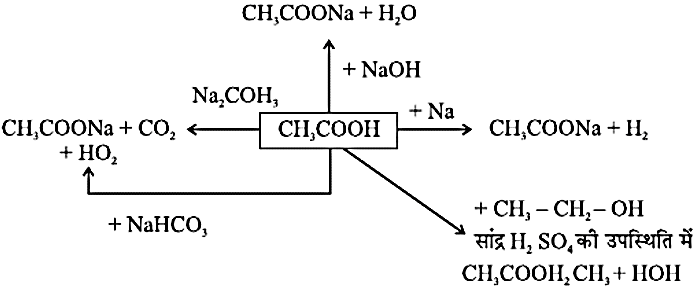
- एस्टरीकरण अभिक्रिया: कार्बोक्सिलिक अम्ल सांद्र सल्फ्यूरिक अम्ल की उपस्थिति में एल्कोहॉल के साथ अभिक्रिया कर मृदु गंध वाले पदार्थ एस्टर बनाते हैं।
- जलीय अवघटन एस्टर अम्ल या क्षारक के साथ अभिक्रिया करके प्रारंभिक ऐल्कोहॉल तथा कार्बोक्सिलिक अम्ल बनाते हैं।
CH3COOCH2CH3 + NaOH CH3COONa + CH3-CH2OH
CH3COONa + CH3-CH2OH
CH3COOCH2CH2 CH3COOH + C H3-CH2OH
CH3COOH + C H3-CH2OH - एस्टर का क्षारीय जलीय अपघटन साबुनीकरण कहलाता है।
- साबुन तथा अपमार्जक:
- साबुन लंबी श्रृंखला वाले कार्बोक्सिलिक अम्लों के सोडियम एवं पोटाशियम लवण होते हैं।
- साबुन केवल मृदु जल के साथ सफाई क्रिया करते हैं तथा कठोर जल के साथ प्रभावहीन होते हैं।
- अपमार्जक लंबी कार्बोक्सिलिक अम्ल श्रृंखला के अमोनियम एवं सल्फोनेट लवण होते हैं। अपमार्जक मृदु तथा कठोर जल के साथ सफाई प्रक्रिया कर सकते हैं।
- साबुन के अणु में जलरागी एवं जलविरागी समूह होते हैं।
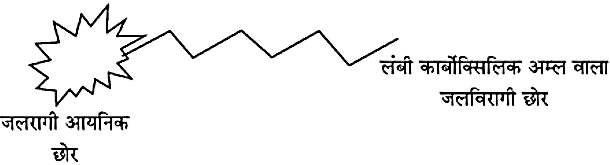
- साबुन के अणु की संरचना
- साबुन की सफाई प्रक्रिया
- अधिकांश मैल तैलीय होता हैं तथा जलविरागी और इस मैल के साथ जुड़ जाता है।
- जल के अणु जलरागी छोर पर साबुन के अणु को घेर लेते हैं।
- फलस्वरूप साबुन के अणु मिसेली संरचना बनाते हैं।
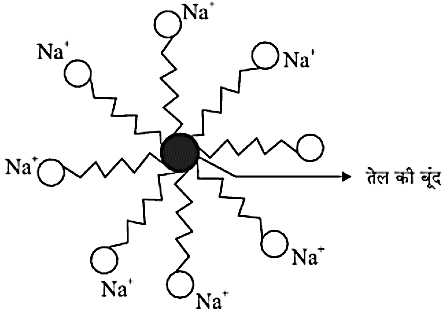
- इस प्रक्रिया में साबुन के अणु और तैलीय मैल का पायस बनता हैं तथा विभिन्न भौतिक विधियों जैसे पटकना, डंडे से पीटना, ब्रुश से रगड़ना आदि की सहायता से वस्त्र साफ होता है।
- अघुलनशली पदार्थ/स्कम
कठोर जल में प्रयुक्त मैग्नीशियम तथा कैल्शियम के लवण साबुन के जलरागी भाग से अभिक्रिया करके अघुलनशील पदार्थ या स्कम बनाते हैं, जिसके कारण सफाई प्रक्रिया बाधित होती है। - अपमार्जक के अणु का आवेशित सिरा कौर जल में उपस्थित कैल्शियम एवं मैग्नीशियम आयनों के साथ अघुलनशील पदार्थ नहीं बनातें, फलस्वरूप सफाई प्रक्रिया प्रभावशाली रूप से संपन्न होती है।
- संक्षेप में-
- कार्बन सर्वतोमुखी तत्व (अधातु) है।
- O, N, H तथा CI जैसी अधातुओं के समान कार्बन का परमाणु संयोजी इलैक्ट्रॉन की साझेदारी करता है।
- श्रृंखलन तथा चतुः संयोजकता के फलस्वरूप कार्बन अधिक यौगिकों का निर्माण करता हैं।
- कार्बन एकल, द्वि और त्रि-आबंध बनाता है।
- कार्बन एवं हाइड्रोजन मिलकर हाइड्रोकार्बन बनाते हैं जो संतृप्त या असंतृप्त हो सकते हैं।
- संरचना के आधार पर हाइड्रोकार्बन सीधी श्रृंखला वाले, शाखित श्रृंखला वाले अथवा चक्रीय हो सकते हैं।
- एक ही अणु में अलग-अलग संरचनात्मक व्यवस्था संभव होती है, इसे समावयवन कहते हैं।
- हाइड्रोकार्बन में, विषम परमाणु हाइड्रोजन को प्रतिस्थापित करते हैं तथा उस यौगिक की रसायनिक विशिष्टताओं को निर्धारित करते हैं।
- समाजातीय श्रेणी में सदस्यों की रासायनिक विशिष्टताएं एक समान तथा भौतिक गुणधर्म भिन्न होते हैं।
- कार्बन आधार वाले यौगिक अच्छे इंधन होते हैं।
- ऐथेनॉल एक महत्वपूर्ण यौगिक हैं। यह क्रियाशील धातुओं के साथ अभिक्रिया करता है। निर्जलीकरण के पश्चात् यह ऐथीन गैस बनाता है।
- ऐथेनोइक अम्ल एक अन्य महत्वपूर्ण यौगिक हैं। यह ऐथेनॉल के साथ अभिक्रिया करके मृदु-गंध वाले एस्टर बनाता है।
- सफाई प्रक्रिया के लिये साबुन एवं अपमार्जक का उपयोग होता है। अपमार्जक मृदु एवं कठोर जल के साथ प्रभावशाली रूप से सफाई अभिक्रिया करते हैं।