धातु एवं अधातु - पुनरावृति नोट्स
CBSE कक्षा 10 विज्ञान
पाठ-3 धातु एवं अधातु
पुनरावृति नोट्स
पाठ-3 धातु एवं अधातु
पुनरावृति नोट्स
- वर्तमान में 118 तत्व ज्ञात हैं। इनमें 90 से अधिक धातु, 22 अधातु तथा कुछ उपधातु हैं।
- सोडियम (Na), पोटाशियम (K), मैग्नीशियम (Mg), लोहा (Fe), एलूमिनियम (Al), कैल्शियम (Ca), बेरियम (Ba) धातुएं हैं।
- ऑक्सीजन (O), हाइड्रोजन (H), नाइट्रोजन (N), सल्फर (S), फास्फोरस (P), फ्लूओरीन (F), क्लोरीन (CI), ब्रोमीन (Br), आयोडीन (I) अधातुएं हैं।
- धातुओं के भौतिक गुणधर्म:
- कक्ष ताप पर ठोस अवस्था में, केवल मर्करी (Hg) तरल रूप में।
- तन्य (धातु को पतले तार के रूप में खींचा जा सकता है।)
- आधातवर्ध्याता (धातु पर आधात कर पतली चादर के रूप में परिवर्तित करना)
- धात्विक चमक
- ध्वानिक
- उच्च गलनांक। कुछ धातुओं का गलनांक कम होता है जैसे, सीजियम एवं गैलियम।
- सामान्यतः ऊष्मा तथा विद्युत के सुचालक। सीसा (pb) एवं मर्करी (Hg) कुचालक हैं। सिल्वर (Ag) तथा कॉपर (Cu) सबसे अच्छे चालक हैं।
- सामान्यतः अधिक घनत्व। सोडियम एवं पोटाशियम का घनत्व एवं गलनांक कम होता है। इन धातुओं को चाकू द्वारा काटा जा सकता है।
- अधातुओं के भौतिक गुणधर्म:
- ठोस एवं गैसीय अवस्था में। ब्रोमीन तरल रूप में।
- सामान्यतः, ये कुचालक हैं। ग्रेफाइट (कार्बन का एक प्राकृतिक स्वरूप) विद्युत एवं ऊष्मा का सुचालक हैं।
- अ-ध्वानिक
- चमकहीन, केवल आयोडीन चमकीला होता है।
- धातुएं क्षारीय ऑक्साइड बनाते हैं। जैसे मैग्नीशियम ऑक्साइड (MgO) (अधातु) अम्लीय (रासायनिक गुणधर्म) ऑक्साइड बनाते हैं। जैसे, अम्लीयवर्षा में।
- धातुओं के रसायनिक गुणधर्मः
- 1. वायु के साथ अभिक्रिया :
धातु वायु में जल सकते हैं, वायु से अभिक्रिया कर सकते हैं या अप्रभावित रहते हैं।
धातु + ऑक्सीजन धातु ऑक्साइड - Na तथा K को आकस्मिक आग बनाने से रोकने के लिये किरोसिन तेल में डुबो कर रखा जाता है।
- Mg, Al, Zn, Pb वायु के साथ धीरे अभिक्रिया करते हैं। इन धातुओं पर ऑक्साइड की पतली सुरक्षा परत चढ़ जाती है।
- Mg वायु में जलने पर सफेद MgO बनाता है।
- Fe एवं Cu वायु में गर्म करने पर प्रज्वलित नहीं होते अपितु अपने ऑक्साइड बनाते हैं। ज्वाला में लौह चूर्ण डालने पर वे तेजी से जलने लगते हैं।
- Ag तथा Au (गोल्ड) ऑक्सीजन के साथ अभिक्रिया नहीं करते।
2Na + O2 Na2O
2Mg + O2 2MgO
2Cu + O2 2CuO
4Al + 3O2 2Al2O3 - उभयधर्मी ऑक्साइड : वे धातु ऑक्साइड जो अम्ल तथा क्षार से अभिक्रिया करते हैं तथा लवण एवं जल उत्पन्न करते हैं।
Al2O3 + HCl AlCl3 + H2O
Al2O3 + NaOH NaAlO2 + H2O - 2. जल के साथ अभिक्रिया :
धातु
ठंडे जल के साथ क्रियाशील, जैसे Na, K, Ca
गर्म जल के साथ क्रियाशील, जैसे Mg
केवल भाप के साथ क्रियाशील जैसे Fe, AI
Na + H2O NaOH + H2
K + H2O KOH + H2
Ca + H2O Ca(OH)2 + H2
Mg + H2O Mg(OH)2 + H2 - Ca तथा Mg की जल से अभिक्रिया के दौरान उत्पन्न हाइड्रोजन गैस के बुलबुले धातु के साथ चिपक जाते हैं तथा धातु तैरना प्रारंभ कर देती हैं।
Al + H2O AI2O3 + H2
Fe + H2O Fe3O4 + H2
(उपरोक्त रसायनिक समीकरणों को संतुलित करने का प्रयास कीजिये।) - 3. तनु अम्लों के साथ अभिक्रिया:
धातु + तनु अम्ल लवण + हाइड्रोजन गैस
सामान्यतः धातुएं तनु अम्ल [HCl] तथा (H2SO4) के साथ अभिक्रिया कर लवण तथा हाइड्रोजन उत्पन्न करती हैं।
Fe + 2HCl FeCl2 + H2
Mg + 2HCl MgCl2 + H2
Zn + 2HCl ZnCl2 + H2
2Al + 6HCl 2AlCl3 + 3H2
कॉपर, मर्करी एवं सिल्वर तनु अम्लों के साथ अभिक्रिया नहीं करते।
उत्पन्न H2 गैस उपचयित हो H2O उत्पन्न करती हैं जब धातु नाइट्रिक अम्ल HNO3 के साथ अभिक्रिया करते हैं। परंतु Mg एवं Mn अति तनु HNO2 के साथ क्रिया करके H2 गैस उत्पन्न करते हैं।
Mg + 2HNO3 Mg(NO3)2 + H2 - 4. धातुओं की अन्य धातु लवणों के साथ अभिक्रिया:
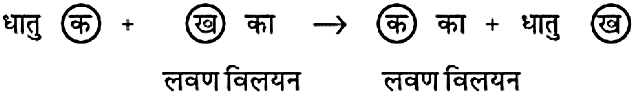
- सभी धातुएं सम-अभिक्रियाशील नहीं होती। अधिक क्रियाशील धातुएं अपने से कम क्रियाशील धातुओं को उनके यौगिक के विलयन या गलित अवस्था में विस्थापित करती है। यह तथ्य धातुओं की सक्रियता श्रेणी का आधार है।
- सक्रियता श्रेणी : वह सूची जिसमें धातुओं की क्रियाशील को अवरोही क्रम में व्यवस्थित किया गया है।
Fe + CuSO4 FeSO4 + CuK कोई धातु इस सूची में अपने से नीचे अथवा बाद में आने वाली धातुओं को विस्थापित करती है। Na सर्वाधिक Ca अभिक्रियाशील Mg Al Zn घटती अभिक्रियाशीलता Fe Pb H Cu Hg Ag Au सबसे कम अभिक्रियाशील
Zn + CuSO4 ZnSO4 + Cu - धातुओं की अधातुओं के साथ अभिक्रिया- तत्वों की अभिक्रियाशील, संयोजकता कोष को पूर्ण करने की प्रवृत्ति के रूप में समझी जा सकती है।
- धातु के परमाणु अपने संयोजकता कोश से इलेक्ट्रॉन त्याग करते हैं तथा धनायन बनाते हैं।
- अधातु के परमाणु संयोजकता कोश में इलेक्ट्रॉन ग्रहण कर ऋणायन बनाते हैं।
- विपरीत आवेशित आयन एक दूसरे को आकर्षित करते हैं तथा मजबूत स्थिर वैद्युत बल में बंधकर आयनिक यौगिक बनाते हैं।
- MgCI2 का निर्माण:
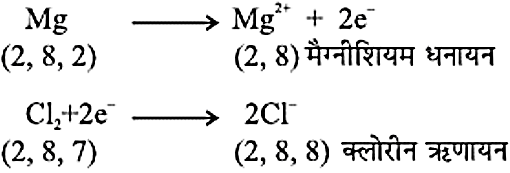
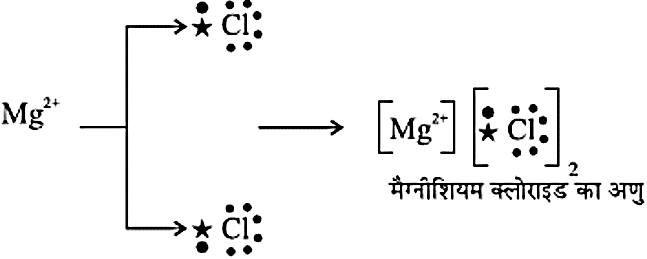
- आयनिक यौगिकों के गुण धर्म-
- कठोर तथा भंगुर।
- उच्च गलनांक एवं क्वथनांक। मजबूत अंतर-आयनिक आकर्षण को तोड़ने के लिये ऊर्जा की पर्याप्त मात्रा में आवश्यकता।
- सामान्यता जल में घुलनशील। किरोसीन एवं पेट्रोल में अघुलनशील।
- गलित अवस्था तथा विलयन रूप में विद्युत के सुचालक। इन अवस्थाओं में आयन उत्पन्न होने के कारण विद्युत प्रवाहित होती है।
- धातुओं की प्राप्ति /धात्विकीः
- खनिज: पृथ्वी में प्राकृतिक रूप से उपस्थित तत्त्व एवं यौगिकों को खनिज कहते हैं।
- अयस्क: वें खनिज जिनमें कोई विशेष धातु काफी मात्रा में होती हैं तथा उसे निकालना लाभकारी होता है।
- सक्रियता श्रेणी में निचली धातुएं स्वतंत्र अवस्था में पाई जाती है। उदाहरण- गोल्ड, सिल्वर, कॉपर। यद्यपि कॉपर तथा सिल्वर सल्फाईड तथा ऑक्साईड अयस्क के रूप में प्राप्त होते हैं।
- सक्रियता श्रेणी के मध्य में उपस्थित धातु प्रमुखतः सल्फाईड, ऑक्साईड तथा कार्बोनेट अयस्क के रूप में प्राप्त होते हैं।
उदाहरण- Zn, Fe, Pb - अधिक क्रियाशील धातुएं स्वतंत्र रूप से नहीं मिलती। जैसे- पोटाशियम, सोडियम, कैल्शियम्।
- गैंगः पृथ्वी खनित अयस्कों में मिट्टी, रेत जैसी अशुद्धियां होती हैं जो गैंग कहलाती हैं।
धात्विक- अयस्क से धातु प्राप्ति की क्रम-गत प्रक्रिया।
- अयस्क का समृद्धिकरण।
- समृद्धित अयस्क से धातु की प्राप्ति।
- अशुद्ध से शुद्ध धातु की परिष्करण द्वारा प्राप्ति।
- सक्रियता श्रेणी में निचली धातुओं का निष्कर्षण:
अयस्क को वायु में गर्म करके- सिनाबार से मर्करी की प्राप्ति

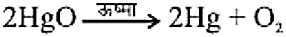
- कॉपर सल्फाईड द्वारा कॉपर की प्राप्ति
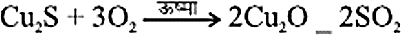
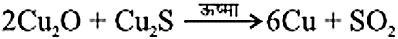
- सिनाबार से मर्करी की प्राप्ति
- सक्रियता श्रेणी के मध्य में स्थित धातुओं का निष्कर्षण- धातु को ऑक्साइड अयस्क से प्राप्त करना सुलभ होता है। इसी कारणवश सल्फाईड एवं कार्बोनेट अयस्कों को ऑक्साईड अयस्क में परिवर्तित किया जाता हैं।
- अयस्क को वायु में अधिक ताप पर गर्म करना
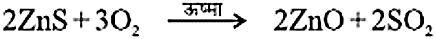
यह भर्जन कहलाता है। - अयस्क को सीमित वायु में अधिक ताप पर गर्म करना
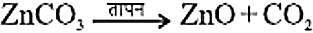
यह निस्तापन कहलाता है।
- अयस्क को वायु में अधिक ताप पर गर्म करना
- धातु ऑक्साईड का अपचयन-
- कोयला प्रयोग करके : अपचयकारक के रूप में कोयला
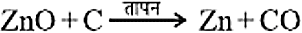
- विस्थापन अभिक्रिया करके : अधिक क्रियाशील धातु जैसे Na, Ca तथा Al का प्रयोग कम क्रियाशील धातुओं को उनके यौगिक से विस्थापित करने में किया जाता है।
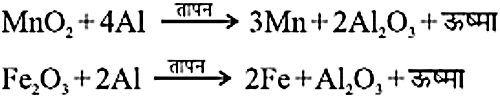
उपरोक्त अभिक्रिया में लोहा गलित रूप में प्राप्त होता है जिसका उपयोग रेल की टूटी हुई पटरियों को जोड़ने में होता है। इस प्रक्रम को थर्मिट अभिक्रिया कहते हैं। - सक्रियता श्रेणी के शीर्ष में उपस्थित धातुओं का निष्कर्षणः
- इन धातुओं की बंधुता कार्बन की अपेक्षा ऑक्सीजन के प्रति अधिक होती है।
- इन धातुओं को बैंद्युत-अपघटनी अपचयन के द्वारा प्राप्त करते हैं। सोडियम को उसके गलित क्लोराइड के विद्युत अपघटन द्वारा प्राप्त करते हैं।
NaCl Na+ + Cl-
- विलयन अथवा गलत अवस्था में विद्युत प्रवाह के पश्चात् कैथोड (ऋण आवेशित) पर सोडियम निक्षेपित हो जाती है तथा ऐनोड ( धन आवेशित) पर क्लोरीन मुक्त होती हैं।
कैथोड पर : Na+ + e- Na
ऐनोड़ पर : 2Cl- Cl2 + 2e- - धातुओं का परिष्करण
प्राप्त धातुओं की अशुद्धियां या अपद्रव्य को वैद्युत अपघटनी परिष्करण द्वारा हटाया जा सकता है। शुद्ध कॉपर को इस विधि से प्राप्त किया जाता हैं। वैद्युत अपघटन उपकरण में निम्नलिखित प्रयुक्त होते हैं।- ऐनोड - अशुद्ध कॉपर धातु की छड़
- कैथोड - शुद्ध कॉपर धातु की छड़
- विलयन - कॉपर सल्फेट के जलीय विलयन के साथ सूक्ष्म मात्रा में तनु सल्फ्यूरिक अम्ल।
- विद्युत प्रवाह करने के पश्चात ऐनोड से अशुद्ध धातु विद्युत अपघट्य में घुल जाती है तथा उतनी ही मात्रा में शुद्ध कॉपर विद्युत अपघट्य से कैथोड पर निक्षेपित होती हैं।
- अविलेय अशुद्धियां ऐनोड तल पर निक्षेपित होती हैं जिसे ऐनोड पंक कहते हैं।
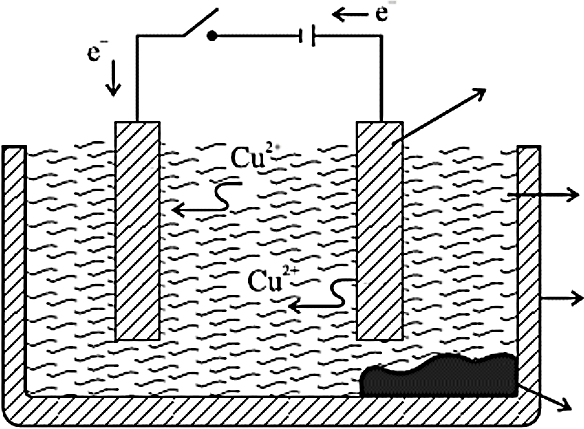
- संक्षारण:
धातुएं अपने आसपास अम्ल, आर्द्रता एवं वायु आदि के संपर्क में आपने पर संक्षारित होती हैं।- सिल्वर - वायु में उपस्थित सल्फर के साथ अभिक्रिया कर
- सिल्वर- सल्फाइड बनाता है तथा वस्तु काली हो जाती हैं।
- लोहा - आर्द्र वायु में लोहे पर भूरे रंग के पत्र की पदार्थ की परत चढ़ जाती हैं जिसे जंग कहते हैं। वायु तथा आर्द्रता लोहे पर जंग लगने के लिए आवश्यक है।
- कॉपर - आर्द्र कार्बन डाइऑक्साइड के साथ अभिक्रिया करके हरे रंग का कॉपर कार्बोनेट बनाता है।
- संक्षारण से सुरक्षा :
लोहे को जंग लगने से पेंट करके, तेल लगाकर, ग्नीज़ लगाकर, यशदलेपन कर, क्रोमियम लेपन द्वारा, ऐनोडीकरण या मिश्रधातु बनाकर, बचाया जा सकता है।- लोहे एवं इस्पात को जंग से सुरक्षित रखने के लिए उन पर जस्ते (जिंक) की पतली परत चढ़ाई जाती है। इसे यशदलेपन प्रक्रम कहते हैं।
- मिश्र धातु : ये धातु तथा अन्य धातुओं अथवा अधातुओं का समांगी मिश्रण कहते हैं।
- सुक्ष्म मात्रा में कार्बन का मिश्रण करने पर लोहा कठोर एवं प्रबल हो जाता हैं।
- लोहे में निकैल और क्रोमियम मिश्रित करने पर स्टेनलैस इस्पात प्राप्त होता हैं जो कठोर एवं जंग-रोधी होता है।
- मर्करी (पारद) को अन्य तत्वों के साथ मिश्रित करने पर अमलगम निर्मित होते हैं।
- पीतल : कॉपर एवं जिंक की मिश्रधातु।
- कांसा : कॉपर एवं टिन की मिश्रधातु।
इन दोनों मिश्रधातु की विद्युत चालकता एवं गलनांक शुद्ध धातु की अपेक्षा कम होता है।
- संक्षेप में:
- अतिशय रूप से धातु ठोस, ध्वनिक, चमकीली, सुचालक, आद्यातवर्ध्य, तन्य, उच्च गलनांक तथा उच्च घनत्व वाली होती है। धातु क्षारीय ऑक्साईड एवं धनायन बनाती हैं।
- अधातुएं सामान्यतः ठोस अथवा गैस, चमकहीन, अध्वानिक, कुचालक तथा निम्न गलनांक वाली होती हैं। ये अम्लीय ऑक्साइड एवं ऋणायन बनाती हैं।
- Na, K तथा Ca कुछ अत्यंत क्रियाशील धातुएं हैं। Mg, AI, Zn तथा Pb इनसे कम क्रियाशील और सोना, चांदी एवं प्लैटिनम सबसे कम क्रियाशील धातुएं हैं।
- सामान्यतः धातु अम्ल से हाइड्रोजन को विस्थापित करते हैं।
- विस्थापन क्षमता के आधार पर सक्रियता श्रेणी बनाई गई है। इस श्रेणी में धातुओं को क्रियाशीलता के घटते क्रम में व्यवस्थित किया गया है।
- धातु एवं अधातु परस्पर क्रिया कर आयनिक यौगिकों का निर्माण करते हैं जो जल में घुलनशील, उच्च गलनांक वाले पदार्थ होते हैं जो गलित अवस्था तथा जलीय विलयन में विद्युत का प्रवाह करते हैं।
- अयस्क वे खनित होते हैं जिनसे लाभकारी रूप से कोई धातु प्राप्त होती हैं।
- धातुओं का निष्कर्षण उनकी अभिक्रियाशीलता के अनुसार किया जाता है।
- सल्फाईड एवं क्लोराईड अयस्कों का भर्जन तथा कार्बोनेट अयस्कों का निस्तापन किया जाता है।
- विद्युत अपघटनी परिष्करण द्वारा परिशुद्ध धातुएं प्राप्त की जाती हैं।
- धातुएं वायु में उपस्थित पदार्थों के साथ अभिक्रिया करके संक्षारित होते हैं। धातुओं के गुणधर्मों में परिवर्तन करने हेतु मिश्रधातु बनाई जाती है।
- स्टील (इस्पात), स्टेनलेस इस्पात, अमलगम, पीतल, कांसा तथा सोल्डर मिश्रधातु के उदाहरण हैं।
