अम्ल, क्षारक एवं लवण - पुनरावृति नोट्स
CBSE कक्षा 10 विज्ञान
पाठ-2 अम्ल, क्षारक एवं लवण
पुनरावृति नोट्स
पाठ-2 अम्ल, क्षारक एवं लवण
पुनरावृति नोट्स
- अम्ल: (ACID)
- ये स्वाद में खट्टे होते हैं।
- ये नीले लिटमस को लाल में बदल देते हैं।
- उदाहरण-
हाइड्रोक्लोरिक अम्ल HCl
सल्फयूरिक अम्ल H2SO4
नाइट्रिक अम्ल HNO3
एसिटिक अम्ल CH3COOH
- क्षार : (Base)
- ये स्वाद में कड़वे होते हैं।
- ये लाल लिटमस को नीले में बदल देते हैं।
- उदाहरण-
सोडियम हाइड्रोक्लोरिक NaOH
पोटेशियम हाइड्रोक्साइड KOH
कैल्सियम हाइड्रोक्साइड Ca(OH)2
अमोनियम हाइड्रोक्साइड NH4OH
- कुछ प्राकृतिक अम्ल
सिरका - एसिटिक अम्ल
संतरा, नींबू - सिट्रिक अम्ल
टमाटर - आक्जैलिक अम्ल
इमली - ट्रारटरिक अम्ल
दही - लैक्टिक अम्ल
चींटी और नेटल का डंक - मिथोनोइक अम्ल - अम्ल-क्षार सूचक- सूचक किसी दिए गए विलयन में अम्ल या क्षार की उपस्थिति दर्शाते हैं।
- लिटमस विलयन- यह एक प्राकृतिक सूचक है। यह लाइकेन से प्राप्त होने वाली नीले रंग की डाई है। सूचकों के अन्य उदाहरण हैं लाल पत्ता गोभी, पेटिनया फूल की रंगीन पंखुड़ियां एवं हल्दी।
- गंधीय सूचक- ऐसे पदार्थ जिनकी गंध अम्लीय या क्षारकीय माध्यम में बदल जाती है। उदाहरण प्याज और लौंग।
अम्ल-क्षार सूचक क्रम सं. सूचक का नाम अम्ल के साथ रंग में परिवर्तन क्षार के साथ रंग में परिवर्तन (क) नीला लिटमस विलयन लाल रंग में परिवर्तन रंग परिवर्तन नहीं होता (ख) लाल लिटमस विलयन कोई परिवर्तन नहीं नीले रंग में बदल जाता है (ग) हल्दी कोई परिवर्तन नहीं लाल रंग में बदल जाता है (घ) मिथाइल ओरेंज लाल रंग में बदल जाता है पीले रंग में बदल जाता है (ङ) फिनोफ्थलीन (रंगहीन) कोई परिवर्तन नहीं गुलाबी रंग में बदल जाता है - तनु अम्ल- जिसमें अल्प मात्रा में अम्ल तथा अधिक मात्रा में जल होता हैं।
- सान्द्र अम्ल- सान्द्र अम्ल में अम्ल अधिक मात्रा में होता है जबकि जल अल्प मात्रा में होता है।
- अम्ल व क्षारों के रासायिनक गुण
अम्ल + धातु लवण + हाइड्रोजन
2HCl + Zn ZnCI2 + H2
2HNO3 + Zn Zn(NO3)2 + H2
H2SO4 + Zn ZnSO4 + H2
2CH3COOH + Zn (CH3COO)2Zn + H2 - पॉप टैस्ट- हाइड्रोजन गैस से निहित परखनली के पास जब एक जलती हुई मोमबत्ती लाई जाती हैं। तो पॉप की ध्वनि उत्पन्न होती हैं। इस टैस्ट को हाइड्रोजन की उपस्थिति दर्शाने के लिए प्रयोग करते हैं।
- क्षार + धातु लवण + हाइड्रोजन
NaOH + Zn Na2ZnO2 (सोडियम जिंकेट) + H2 - क्षारों के साथ सभी धातुएं इस प्रकार अभिक्रिया नहीं करतीं।
- अम्लों की धातु कार्बोनेट तथा धातु बाईकार्बोनेटों के साथ अभिक्रिया
धातु कार्बोनेट - अम्ल लवण + कार्बन डाइआक्साइड + जल
Na2CO3(s) + 2HCl(l) 2NaCl(aq) + H2O(l) + CO2(g)
धातु बाईकार्बोनेट + अम्ल लवण + कार्बन डाइआक्साइड + जल
NaHCO3(s) + HCI(l) NaCl(aq) + CO2(g) + H2O(g) - चूने के पानी का टैस्ट- उत्पादित कार्बन डाइआक्साइड को चूने के पानी से प्रवाहित करने पर
Ca(OH)2(aq) + CO2(g) CaCO3(s)(सफ़ेद अवक्षेप) + H2O(l)
अधिक मात्रा में CO2 प्रवाहित करने पर निम्न अभिक्रिया होती हैं।
CaCO3(s) + H2O(l) + CO2(g) Ca(HCO3)2aq - उदासीनीकरण अभिक्रिया
क्षार + अम्ल लवण + जल
NaOH(aq) + HCI(aq) NaCl(aq) + H2O(I)
जब अम्ल द्वारा क्षारक का प्रेक्षित प्रभाव तथा क्षारक द्वारा अम्ल का प्रभाव समाप्त हो जाता है और परिणामस्वरूप लवण और जल प्राप्त होते हैं तो उदासीनीकरण अभिक्रिया होती हैं। - अम्लों के साथ धात्विक आक्साइड की अभिक्रियाएं धात्विक आक्साइड + अम्ल लवण + जल
CuO + HCl CuCl2 + H2O
नोट- कॉपर क्लोराइड के बनने के कारण विलयन का रंग नीला हो जाता है। - धात्विक आक्साइड को क्षारीय आक्साइड भी कहते हैं क्योंकि ये अम्ल के साथ क्रिया करके लवण और जल बनाते हैं।
- अधात्विक आक्साइड की क्षारों के साथ अभिक्रिया
अधात्विक आक्साइड + क्षार लवण + जल
Ca(OH)2 +CO2 CaCO3 + H2O
नोट- अधात्विक आक्साइड प्रवृत्ति में अम्लीय होते हैं क्योंकि ये क्षार के साथ अभिक्रिया करने पर लवण और जल बनाते हैं। - सभी अम्लीय विलयन विद्युतधारा प्रवाहित करते हैं।
- बल्ब का जलना इस बात को दर्शाता है कि अम्लीय विलयन में विद्युत धारा प्रवाहित होती हैं।
- जलीय विलयन में अम्ल और क्षारक
जल की उपस्थिति में अम्ल H'ions उत्पन्न करते हैं।
HCl + H2O H3O+ + Cl-
H3O+ - हाइड्रोजन आयन
H+ + H2O H3O+
- जल की उपस्थिति में क्षार आयन OH+ उत्पन्न करते हैं।
Mg(OH)2(g) Mg2+(aq) + 2OH-(aq) - क्षार- सभी क्षारक जल में घुलनशील नहीं होते हैं। जल में घुलनशील क्षारक को क्षार कहते हैं। कुछ आम क्षार हैं-
NaOH - सोडियम हाइड्रोक्साइड
KOH - पोटैशियम हाइड्रोक्साइड
Ca(OH)2 - कैल्शियम हाइड्रोक्साइड
NH4OH - अमोनियम आइड्रोक्साइड - नोट- सभी क्षार क्षारक होते हैं परन्तु सभी क्षारक क्षार नहीं होते।
- जल के साथ अम्ल या क्षारक को मिलाते समय सावधानी बरतनी चाहिए। हमेशा अम्ल या क्षारक को ही जल में मिलाना चाहिए और लगातार इसे हिलाते रहना चाहिए, क्योंकि यह प्रक्रिया अत्यंत ऊष्माक्षेपी है।
- जब कोई अम्ल या क्षारक को जल में मिलाया जाता हैं तो ये तनुकृत जाते हैं। जल में मिलाने पर आयन की सांद्रता H3O + orOH में प्रति इकाई आयतन में कमी हो जाती है।
- क्षार तथा अम्ल की प्रबलता
किसी क्षार या अम्ल की प्रबलता उसके द्वारा उत्पन्न H+ आयन या OH आयनों की संख्या पर
निर्भर करती है।
किसी अम्ल या क्षारक की प्रबलता हम एक सार्वभौमिक सूचक द्वारा ज्ञात कर सकते हैं। इस सूचक को PH स्केल कहते हैं।
PH= पुसाांस एक जर्मन शब्द है जिसका अर्थ है शक्ति
यह स्केल O (अति अम्लीय) से 14 अति क्षारीय तक pH ज्ञात करने के लिए उपयोग में लाया जाता है। - जल उदासीन है इसका pH7 है।
- pH पेपर- यह एक विशेष प्रकार का पेपर है जिसे pH ज्ञात करने के लिए उपयोग में लाया जाता है।
pH की विभिन्नता क्र. सं. pH का मान pH पेपर का रंग विलयन की प्रकृति H+ आयन सांद्रता OH- आयन सांद्रता 1. 0 गहरा लाल अति अम्लीय अत्यधिक अति अल्प 2. 4 संतरी या पीला अम्लीय अधिक अल्प 3. 7 हरा उदासीन बराबर बराबर 4. 10 नीला हरा या नीला क्षारीय अल्प अधिक 5. 14 गहरा नीला या जामुनी अति क्षारीय अति अल्प अत्यधिक - प्रबल अम्ल अधिक मात्रा में H+ आयन उत्पन्न करते हैं।
उदाहरण- HCI, H2SO4 और HNO3. - दुर्बल अम्ल कम मात्रा में आयन उत्पन्न करते हैं।
उदाहरण CH3 COOH, H2CO3 (कार्बोनिक अम्ल) - प्रबल क्षार- प्रबल क्षार अधिक मात्रा में OH- आयन उत्पन्न करते हैं।
उदाहरण- सोडियम हाइड्रोक्साइड, पौटेशियम हाइड्रोक्साइड, कैल्शियम हाइड्रोक्साइड - दुर्बल क्षार- ये कम OH आयन उत्पन्न करते हैं।
उदाहरण- NH4OH - दैनिक जीवन में pH का महत्व
- पाचन तंत्र में pH का महत्व
हमारे उदर में pH का स्तर हमारी कार्यशैली को नियंत्रित करता है। अपच की स्थिति में उदर अत्यधिक मात्रा में अम्ल उत्पन्न करता है जिससे उदर में दर्द तथा जलन का अनुभव होता है। इस दर्द से मुक्त होने के लिए antacid जैसे क्षारकों का उपयोग किया जाता है। यह एन्टैसिड़ अम्ल की आधिक्य मात्रा को उदासीन करता है। - अम्लीय वर्षा का pH - वर्षा के जल में pH का मान 5.6 से कम होने पर यह अम्लीय वर्षा कहलाती हैं। जब अम्लीय वर्षा का जल नदियों में बहता हैं तो इसका pH मान भी कम हो जाता है। जिससे जलीय जीवधारियों की उत्तरजीविता कठिन हो जाती है।
- बगीचे की मिट्टी का pH- अच्छी उपज के लिए पौधों को एक विशिष्ट pH परास की आवश्यकता होती है। यदि किसी स्थान की मिट्टी का pH कम या अधिक हो तो किसान उसमें आवश्यकतानुसार अम्लीय या क्षारीय उर्वरक मिलाते हैं।
- हमारा शरीर 7.0 से 7.8 pH परास के बीच कार्य करता है। जीवित प्राणी केवल संकीर्ण pH परास में जी जीवित रह सकते हैं।
- दंत क्षय और pH - मुंह में उपस्थित बैक्टीरिया मुंह में उपस्थित शर्करा एवं खाद्य पदार्थों का निम्नीकरण करके अम्ल उत्पन्न करते हैं। दंत मंजन के उपयोग से अम्ल की आधिक्य मात्रा को उदासीन किया जाता है जिसके परिणाम स्वरूप दंत क्षय को रोका जा सकता है।
- लवण के संबंध में अधिक जानकारी
लवण परिवारक्रम. सं. लवण का नाम सूत्र प्रयुक्त क्षार प्रयुक्त अम्ल 1. पोटेशियम सल्फेट K2SO4 KOH H2SO4 2. सोडियम सल्फेट Na2SO4 NaOH H2SO4 3. सोडियम क्लोराइड NaCl NaOH HCl 4. अमोनियम क्लोराइड NH4Cl NH4OH HCl - नोट- सोडियम क्लोराइड तथा सोडियम सल्फेट सोडियम परिवार से संबंध रखते हैं क्योंकि उनमें एक समान प्रकार का मूलक है इसी प्रकार सोडियम क्लोराइड तथा पोटेशियम क्लोराइड भी क्लोराइड लवणों के परिवार से संबंध रखते हैं।
- उदासीन लवण
प्रबल अम्ल + प्रबल क्षार
pH मान = 7
उदाहरण- NaCl2, CaSO4 - अम्लीय लवण
प्रबल अम्ल + दुर्बल क्षार
pH का मान 7 से कम
उदाहरण- NH4CI, NH4NO3 - क्षारीय लवण
प्रबल क्षार + दुर्बल अम्ल
pH का मान 7 से अधिक
उदाहरण- CaCO3, CH3COONa - साधारण मनक - रसायनों का कच्चा पदार्थ
- सोडियम क्लोराइड NaCl को साधारण नमक कहा जाता है जिसे हम भोजन में इस्तेमाल करते हैं। इसे समुद्री जल से बनाया जाता है।
- रॉक Salt एक भूरे रंग की क्रिस्टल के रूप में पाया जाने वाला पदार्थ है। इसे कोयले की तरह निष्कर्षण करके प्राप्त किया जाता है।
- साधारण नमक हमारे दैनिक जीवन में काम आने वाले बहुत से रसायनों का महत्वपूर्ण कच्चा पदार्थ है।
उदाहरण- सोडियम हाइड्रोक्साइड, बेकिंग सोडा, वाशिंग सोडा तथा ब्लीचिंग पाउडर। - सोडियम हाइड्रोक्साइड
बनाने की विधि- सोडियम हाइड्रोक्साइड को बनाने के लिए क्लोर-क्षार प्रक्रिया का इस्तेमाल किया जाता है। इसे क्लोर-क्षार प्रक्रिया इसलिए कहते हैं क्योंकि इससे निर्मित पदार्थ क्लोरीन तथा क्षार हैं।
2NaCl(aq) + 2H2O(l) 2NaOH(aq) + CI2(g) + H2(g)लवण NaCIकैथोड पर हाइड्रोजन गैसएनोड पर क्लोरीन गैस जय संयोधन, PVC, CFC's तथा कीटनाशक बनानाNaOH साबुन तथा डिटर्जेंट, कागज तथा फाइबर बनानाईंधन तक उर्वरक में प्रयोग HCI
प्रयोग - उद्योगों में, दवाइयाँ तथा सौन्दर्य प्रसाधनब्लीच
प्रयोग - घरों में सफाई के लिए, कपड़े को रंगने में - ब्लीचिंग पाउडर या विरजंक चूर्ण
बनाने की विधि- Ca(OH)2 + Cl2 CaOCI2 + H2O
(कैल्शियम हाइड्रोक्साइड + क्लोरीन गैस विरजंक चूर्ण + जल)
प्रयोग- सूत और सूती कपड़े का रंग उड़ाने में- फैक्ट्रियों तथा लांड्री में
- पेयजल को संक्रमण रहित करने में
- बेकिंग सोडा या सोडियम हाइड्रोजन कार्बोनेट
बनाने की विधि-
सोडियम हाइड्रोजन कार्बोनेट को ऊष्मा देने पर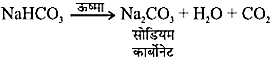
इस प्रक्रिया में उत्पादित CO2 केक, पेस्ट्री आदि को फुला देती है और उन्हें मुलायम बनाती है। - उपयोग
- घरेलू कार्यों में इस्तेमाल किया जाता हैं।
- बेकिंग पाउडर बनाने में प्रयोग क्योंकि जब बेकिंग सोडा को ऊष्मा मिलती हैं तो निम्न प्रक्रिया होती हैं।
NaHCO3 + H- CO2 + H2O + Na2CO3 - एन्टासिड को बनाने में बेकिंग सोडा प्रयुक्त किया जाता हैं।
- वाशिंग सोडा
बनाने की प्रक्रिया- सोडियम कार्बोनेट को जल में घोलकर क्रिस्टलीकृत किया जाता है।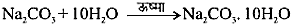
उपयोग:-- काँच, साबुन और कागज के निर्माण में प्रयुक्त
- घरेलू कार्यों में सफाई के लिए
- कठोर जल को मृदु बनाने के लिए
- बोरेक्स के निर्माण के लिए।
- क्रिस्टलन जल- लवण के एक इकाई सूत्र में जल के निश्चित अणुओं की संख्या को क्रिस्टलन का जल कहते हैं।
- कॉपर सल्फेट के क्रिस्टल को क्वथन नली में गर्म करने पर क्वथन नली में जल की बूंदें दिखाई पड़ती हैं।
- जलीय कॉपर सल्फेट का रासायनिक सूत्र है- CuSO4, 5H2O
- जिप्सम में भी क्रिस्टलन का जल पाया जाता है।
- जिप्सम का रासायनिक सूत्र- CaSO4, 2H2O जब जिप्सम को 373 k पर गर्म किया जाता है तो यह CaSO4.½H2O (प्लास्टर और पेरिस) में बदल जाता है।
CaSO4,½H2O + 1½H2O CasO4.2H2O - प्लास्टर और पेरिस का उपयोग- प्लास्टर और पेरिस का प्रयोग खिलौने बनाने में, सजावट का सामान बनाने में तथा सतह को समतल बनाने में किया जाता है।
- प्लास्टर और पेरिस का प्रयोग डाक्टर टूटी हुई हड्डी को जोड़ने में करते हैं।
