रासायनिक अभिक्रियाएँ एवं समीकरण - पुनरावृति नोट्स
CBSE कक्षा 10 विज्ञान
पाठ-1 रासायनिक अभिक्रियाएँ एवं समीकरण
पुनरावृति नोट्स
पाठ-1 रासायनिक अभिक्रियाएँ एवं समीकरण
पुनरावृति नोट्स
- रासायनिक परिवर्तन- जब कभी कोई रासायनिक परिवर्तन होता है तो हम उसे रासायनिक अभिक्रिया कहते हैं।
उदाहरण- हमारे शरीर में भोजन का पाचन
- लोहे का जंग लगना
- रासायनिक समीकरण- रासायनिक अभिक्रिया को संकेतों के माध्यम से रासायनिक समीकरण द्वारा व्यक्त किया जाता है।
उदाहरण- मैग्नीशियम धातु का दहन करने पर मैग्नीशियम आक्साइड का उत्पादन होना
Mg + O2 MgO - किसी भी रासायनिक अभिक्रिया को कुछ परिवर्तनों के आधार पर पहचाना जा सकता है जिनमें मुख्य अवस्था या रंग में परिवर्तन, गैस का उत्सर्जन या तापमान में परिवर्तन।
- रासायनिक अभिक्रियाओं को अधिक सूचनात्मक बनाने के लिए उनकी भौतिक स्थिति को दर्शाया जाता है जैसे गैस के लिए (g) द्रव लिए (l) ठोस के लिए (s) तथा जलीय विलयन के लिए (aq)।
- संतुलित रासायनिक समीकरण- अभिकारक तथा उत्पाद के प्रत्येक तत्व के परमाणुओं की संख्या को समान करने के लिए उसे संतुलित किया जाता है।
उदाहरण- Fe(s) + H2O(l) Fe2O3(s) + H2(g) को इस प्रकार संतुलित किया जा सकता है। 3Fe(s) + 4H2O(g) Fe2O3(s) + 4H2(g) - संयोजन अभिक्रिया- जिन अभिक्रियाओं में दो या दो से अधिक पदार्थ मिलकर एक पदार्थ बनाते हैं, उन्हें संयोजन अभिक्रिया कहते हैं।
उदाहरण- CaO + H2O Ca(OH)
* {CaO - कैल्शियम आक्साइड (चूना पत्थर)}
* {H2O - जल}
Ca(OH) - कैल्शियम हाइड्रोक्साइड (बुझा हुआ चूना) - Ca(OH)2 को घरों में सफेदी के लिए प्रयुक्त किया जाता है। यह CO2 के साथ क्रिया करके CaCO3 बनाता है जिससे दीवारों पर चमक आती है।
Ca(OH)2(aq) + CO2(g) CaCO3(s) + H2O (l)
* {Ca(OH)2 - कैल्शियम हाइड्रोसाइड}
* {CaCO3 - कैल्शियम कार्बोनेट}
कोयले का दहन
C(s) + O2(g) CO2(g)
जल का बनना
2H2(g) + O2(g) 2H2O(I) - ऊष्माक्षेपी ऊष्मा उन्मोची अभिक्रियाएँ- वे अभिक्रियाएँ जिनमें अभिक्रिया के दौरान ऊष्मा निकलती हैं।
उदाहरण- CH4(g) + 2O2(g) CO2(g) + 2H2O(g)- श्वसन भी ऊष्माउन्मोची अभिक्रिया है।
- शाक सब्जियों का विघटन होकर कम्पोस्ट में बदलना।
- विघटन अभिक्रियाएँ- ऐसी अभिक्रियाएँ जिनमें एकल अभिकारक विघटित होकर दो या अधिक उत्पादों का निर्माण करता है। विघटन अभिक्रियाएँ तीन प्रकार की होती है।
वियोजन अभिक्रियाएँ- ऊष्मीय वियोजन- ऊष्मा के द्वारा की गई वियोजन अभिक्रिया
उदाहरण-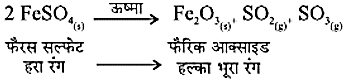
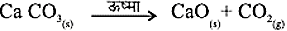
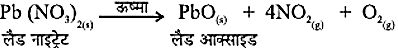
- विद्युतीय वियोजन- जलीय वियोजन मैं ऊर्जा विद्युत के रूप में प्रदान की जाती है।
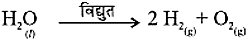
- प्रकाशीय वियोजन- जब वियोजन के लिए प्रकाश के रूप में ऊर्जा प्रदान की जाती है।

सिल्वार ब्रोमाइड भी इसी प्रकार अभिक्रिया करता है।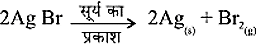
- ऊष्मीय वियोजन- ऊष्मा के द्वारा की गई वियोजन अभिक्रिया
- ऊपरलिखिति दोनों अभिक्रियाओं का उपभोग श्वेत-श्याम फोटोग्राफी में किया जाता हैं।
- ऊष्माशोषी अभिक्रियाएँ- ऊष्मा अभिक्रियों में ऊष्मा का शोषण होता है।
2Ba(OH)2 + NH4Cl 2BaCl2 + NH4OH - विस्थापन अभिक्रियाएँ- ऐसे अभिक्रियाएं जिनमें एक तत्व दूसरे तत्व को उसके जलीय विलयन से विस्थापित करता है।
Fe(s) + CuSO4(aq) FeSO4(aq) + Cu(s)
लोहे की कीलों का रंग भूरा हो जाता है और कापर सल्फेट का नीला रंग फीका हो जाता हैं।
Zn(s) + CuSO4(aq) ZnSO4(aq) + Cu(s)
Pb(s) + CuCl2(sq) PbCl2(aq) + Cu(s)
जिंक और सीसा धातु कापर की अपेक्षा अधिक अभिक्रियाशील है। ये कापर धातु को उसके यौगिक से विघटित कर देती है। - द्विविस्थापन अभिक्रियाएँ- ऐसी अभिक्रियाएँ जिनमें दो भिन्न यौगिक क्रिया करके दो नए यौगिक बनाते हैं।
Na2SO4(aq) + BaCl2(aq) BaSO4(s) + 2NaCl(sq)
उपरोक्त अभिक्रिया के परिणामस्वरूप एक सफेद रंग का अवक्षेप बनता है। - अवक्षेपण अभिक्रिया- जिस अभिक्रिया में अवक्षेप का निर्माण होता हैं उसे अवक्षेपण अभिक्रिया कहते हैं।
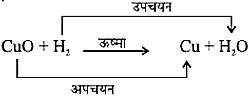
Pb(NO3)2(aq) + 2KIaq PbI2 + 2KNO3 - उपचयन- अभिक्रिया के दौरान जब किसी पदार्थ में आक्सीजन की वृद्धि या हाइड्रोजन का ह्रास होता है तो उसे उपचयन कहते हैं।
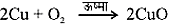
जब कॉपर को गर्म किया जाता है तो एक काला रंग आ जाता है। जब इस CuO से हाइड्रोजन गैस गुजारी जाती है तो यह दोबारा भूरे रंग का हो जाता है।
- अपचयन- ऐसी अभिक्रिया जिनमें आक्सीजन का ह्रास या हाइड्रोजन की वृद्धि होती हैं।
- रेडोक्स अभिक्रिया- ऐसी अभिक्रियाएँ जिनमें एक अभिकारक उपचयित होता हैं और दूसरा अपचयित होता है।
ZnO + C Zn + CO
MnO2 + 4HCl MnCl2 + 2H2O + Cl2 - संक्षारण- जब किसी धातु की सतह पर वायु, जल या किसी और पदार्थ की धुंधली परत चढ़ जाती है।
- लौहे पर जंग लगना
- चांदी पर काली परत चढ़ना
- विकृत गंधिता- वसायुक्त तथा तैलीय खाद्य सामग्री को लंबे समय तक रखने पर वे विकृत गंधित हो जाते हैं तथा उनका स्वाद व गंध बदल जाते हैं।
- खाद्य सामग्री को विकृत गंधिता से बचाने के लिए उनमें प्रति आक्सीकारक मिलाये जाते हैं।
